Dr. rer. nat. Dipl.-Phys. Ulrich Simon
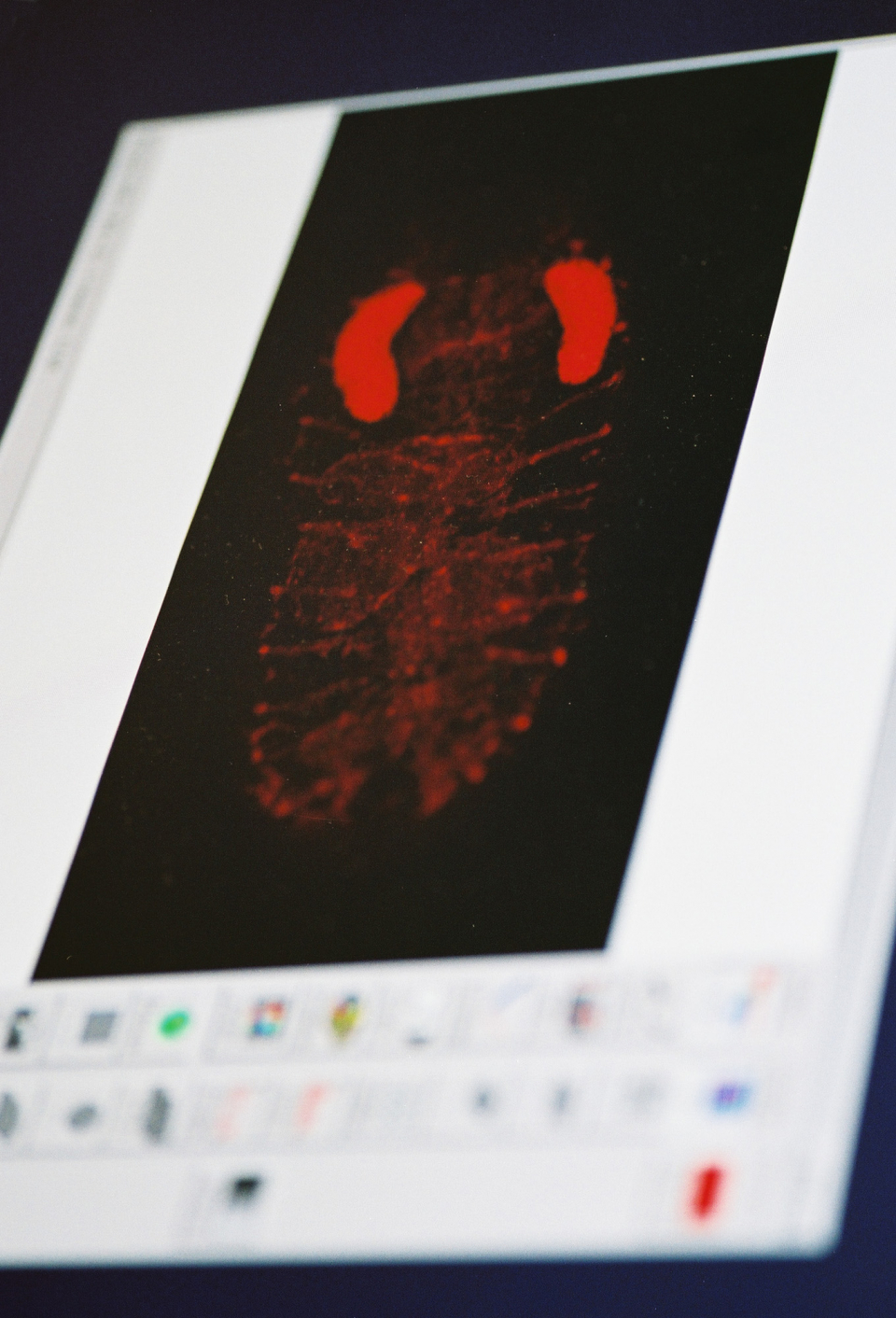
Wir als Carl Zeiss sind zu Hause im Bereich der Mikroskopie, sie ist das älteste Geschäft der Firma, die 1846 hier in Jena von Carl Zeiss als kleine optische Werkstatt gegründet wurde. Die Mikroskopie ist heute noch eine der sechs tragenden Säulen des Geschäftes der Carl Zeiss AG. Heute kann man die Mikroskopie drei verschiedenen Kategorien zuordnen. Zu der ersten gehören die klassischen, traditionellen Mikroskope, die jedermann kennt. Die zweite Klasse Mikroskope umfasst komplexe Systeme, bei denen das eigentliche Mikroskop vielleicht noch 25 Prozent ausmacht, der übrige Teil setzt sich aus Peripheriekomponenten zusammen, wie z. B. Lasern, Computern und verschiedensten Möglichkeiten zur Probenbearbeitung. Schließlich gibt es eine dritte Gruppe. Diese Systeme sehen nicht mehr aus wie die herkömmlichen Mikroskope, sie sind eher mit Mikroskop-Technologien zu beschreiben. Charakteristisch für diese Systeme sind vor allem ein hoher Grad an Automatisierung und Miniaturisierung. Hier fließen über 150 Jahre Erfahrungen in der Entwicklung und Fertigung von Mikroskopen und Technologien bei Carl Zeiss zusammen. Genutzt werden solche Systeme heute in der Pharmaindustrie, die mit ihnen Wirkstoffsuche für neue Medikamente betreibt. Das LSM 510 META gehört zur vorhin genannten zweiten Klasse von Mikroskopen, den hochaufwendigen, hochkomplexen Systemen. Das klassische Mikroskop findet man in diesen Geräten zwar immer noch, wir benutzen aber zum Beispiel in den Laser Scanning Mikroskopen keine herkömmliche Beleuchtungsquelle mehr, sondern einen Laser. Der Unterschied ist folgender: Wird das Objekt mit einer konventionellen Lampe beleuchtet, so erfolgt die Beleuchtung komplett über das ganze Objekt. Wir benutzen stattdessen einen Laser, der zu einer Punktquelle fokussiert wird. Wird diese auf die Probe projiziert, dann beleuchtet sie nur einen einzelnen Punkt. Um ein Bild aufzubauen, muss der Laserstrahl über die Probe geführt werden, Zeile für Zeile, und wie im Fernsehen entsteht auf diese Art und Weise Schritt für Schritt ein Bild. Warum macht man das? Mit diesem Ansatz erzielt man zum einen eine bessere räumliche Auflösung, zum anderen kann man vor allem Farbstoffe, die heute im biomedizinischen Umfeld zur Markierung von Objektbestandteilen eingesetzt werden, sehr vorteilhaft anregen. Die Mikroskopie ist heute, und das trifft insbesondere auf Carl Zeiss zu, zu Hause im biomedizinischen Umfeld. Die Anwender unserer Mikroskope sind also vor allem Professoren, Arbeitsgruppen an Universitäten und anderen Forschungseinrichtungen. Das primäre Thema, dem sich diese Forschungsgruppen widmen, ist das Verstehen von Krankheiten sowie genetischen Proteinveränderungen im Organismus. Nachdem das humane Genom entschlüsselt worden ist - 2001 war der Abschluss von HUGO -, hatte man verstanden, aus welchen Bausteinen sich der Bauplan des Menschen grundsätzlich zusammensetzt. Aber erst wenn man weiß, wie die sich aus diesen Bausteinen - unseren Genen - ableitenden Proteine die Funktionen oder Fehlfunktionen unserer Zellen bestimmen, wird man die Ursachen von Krankheiten erkennen können. Und jetzt kommen wir auch zu dem, was wir mit unserem Produkt erreicht haben: Man möchte also die Verknüpfung zwischen dem Krankheitsbild und den körpereigenen Proteinen studieren. Diese Proteine sind mal fehlerhaft, mal sind zu viele, mal sind zu wenige da. Und das führt zu Fehlfunktionen in der Zelle. Genau dieser Zusammenhang ist wichtig. Was muss ich tun, um diese Beziehungen untersuchen zu können? Zunächst sind Zellen, wenn ich in ein Mikroskop schaue, nahezu transparent. Um die Strukturen sichtbar zu machen, muss ich sie zuvor markieren. Dazu nutzt man spezielle Farbstoffe. Die Problematik war folgende: In der Vergangenheit hat man klassische synthetische Farbstoffe, wie Rhodamin und DAPI, zur Markierung genutzt. Werden aber solche Farbstoffe in eine lebende Zelle eingebracht - und wir müssen an lebenden Zellen arbeiten, denn wir wollen Dynamik und Funktion verstehen -, dann stirbt diese Zelle in der Regel relativ schnell. Das heißt, man kann das Experiment nicht mehr durchführen. Jetzt hat man kürzlich neue Farbstoffe nutzbar gemacht, das sind die so genannten fluorescent proteins, fluoreszierende Eiweiße, die man aus Quallen gewinnt. Mit diesen Farbstoffen können in der Zelle Markierungen vorgenommen werden, wobei die Zelle - und das ist der wesentliche Schritt - am Leben bleibt. Eine weitere Aufgabe bei der Untersuchung der Vorgänge in der Zelle besteht nun darin, möglichst viele zelluläre Strukturen gleichzeitig abzubilden. Das Problem ist, dass die Farben der fluoreszierenden Proteine aus der Qualle alle sehr dicht beieinander liegen. Auf einmal ist alles im Bild nur noch grün. Obwohl unterschiedliche fluoreszierende Proteine benutzt wurden, können einzelne Farben im Bild nicht mehr getrennt werden. Hier haben wir angesetzt und zusammen mit den Forschern vom CalTech (California Institute of Technology) in Pasadena und dem JPL, das ist das Jet Propulsion Laboratory, eine Institution der NASA in Pasadena, eine entsprechende Technologie entwickelt. Dort war zu Verteidigungszwecken ein Programm aufgelegt worden mit dem Ziel, über Satellitenüberwachung grüne Panzer unter grünen Bäumen zu detektieren. Diese militärische Anwendung haben wir übertragen auf unser Gebiet, und wir haben unseren Mikroskopen beigebracht, diese vielen verschiedenen grünen Farbstoffe zu trennen, selbst wenn sie sich in ihren spektralen Charakteristika fast vollständig überlappen. Die Wirkung war einfach atemberaubend.
Dr. rer. nat. Bernhard Zimmermann
Der große Schritt nach vorne war, dass es mit dem System zum ersten Mal möglich war, die Farbnuancen der fluorescent proteins zu unterscheiden. Das Problem begann häufig schon dann, wenn zwei dieser Farbstoffe gleichzeitig eingesetzt werden sollten. Dadurch, dass jetzt mehrere dieser Farbstoffvarianten miteinander verwendet werden konnten, wurden die starken Einschränkungen beim Einsatz der Farbstoffe aufgehoben und die bisherigen massiven Kompromisse bei der Durchführung der Experimente ausgeräumt.
Dipl.-Phys. Ralf Wolleschensky
Die größte Herausforderung war, dass wir bei Objekten aus der Zellbiologie mit extrem schwachen Signalen zu kämpfen hatten. Wir mussten uns entsprechende Anordnungen überlegen, mit denen wir effizient diese geringen Probensignale detektieren können, ohne die Probe dabei zu schädigen. Es gibt zwei Wege, die Signalstärke zu erhöhen: Zum einen kann man die Probe stärker beleuchten, damit kann es unter Umständen zu Schädigungen kommen. Oder aber ich versuche, die Photonen, die in geringer Anzahl vorliegen, zu sammeln und effizient auf den Detektor zu bringen. Letzteres haben wir mit unserer Technologie getan.
Nachfrage: Ist das jetzt eine konsequente Weiterentwicklung einer bestehenden Technologie, oder ist das eine echte Innovation?
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Es ist mit Sicherheit eine echte Innovation. Wir versuchen grundsätzlich, die Kundenanforderungen zu verstehen. In diesem Fall - Herr Zimmermann hat es beschrieben - wollten die Wissenschaftler möglichst viele einer bestimmten Art von Farbstoffen trennen. Wir haben begonnen, das Problem systematisch zu analysieren: Wie kann man überhaupt Farben dieser Art trennen und letztendlich sichtbar machen? 15 bis 18 Jahre lang hat die konfokale Mikroskopie Farbfilter genutzt, um Fragestellungen in ähnlicher Form praktisch zu lösen. Jetzt war es notwendig, sich Gedanken zu machen, welche Möglichkeiten es noch gibt, um aus einem Lösungsspektrum die richtigen Ansätze, die erfolgversprechende Technologie zu finden. Das letztendlich ausgewählte Detektionsverfahren verwendet ein optisches Gitter zum Zerlegen der Signale in ihre Farbkomponenten. Diese Komponenten werden mit Hilfe eines Computeralgorithmus verrechnet, so dass die einzelnen Farbstoffe sichtbar werden. Die Innovation ergibt sich für den Anwender aus der Möglichkeit, beliebige, auch farblich stark überlappende Farbstoffe gleichzeitig einzusetzen und aus dem alten Trott bezüglich der Markierungen auszubrechen. Wir schauen uns immer die Arbeitsabläufe beim Anwender im Labor an und versuchen, so tief und systematisch wie möglich die dort vorliegende Fragestellung zu durchdringen und vorhandene Stolpersteine zu erkennen. Deren negative Auswirkungen auf die verschiedenen Faktoren, seien es Kosten, seien es Kompetenz beim Projekt etc., wollen wir mit unseren Entwicklungen beseitigen. Das ist uns mit dem LSM 510 META gelungen. Für den Kunden war dieses Produkt, diese Innovation, ein riesiger Schritt nach vorn. Man sieht es an den Reaktionen, die uns Recht geben. Das heißt, wir hatten begriffen, wohin sich die Anwendungen entwickeln werden und wohin sich die Technologie bewegen muss. Und als sie dann da war, war der Kunde überrascht, dass sie existiert.
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Genau dieses Übertragen von einer Anwendung auf eine völlig neue war wichtig. Ich sehe übrigens Innovation in einem bestimmten Arbeitsfeld häufig einfach dadurch gegeben, dass man Analogieschlüsse aus existierenden Feldern in neue Felder zieht.
Ihre Kunden hatten das Glitzern in den Augen ... Was hat der "normale Mensch" von dem, was hier bei Ihnen entwickelt wurde?
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Wir erwarten, dass durch dieses Markieren der Proteine in der Zelle ein deutlich besserer Zusammenhang zwischen Krankheitsbildern, letztendlich Krankheitsursachen und dem Proteinaufkommen in Zellen erstellt werden kann. Wenn wir uns heute Krankheitsverläufe anschauen, ist festzustellen, dass wir in der Regel nur Symptome detektieren. Sowohl die Diagnose als auch die Therapie setzen häufig nur an Symptomen an, die Ursache der Krankheit bleibt unverstanden. Ich detektiere beispielsweise einen Tumor, das ist aber nicht die Ursache, sondern das Symptom. Nach dessen Entfernen wird der Patient chemotherapeutisch oder medikamentös weiterbehandelt. Wenn wir Pharmawirkstoffe untersuchen, was teilweise auch mit unseren Systemen durchgeführt wird, dann ist es so, als ob man die Nadel im Heuhaufen sucht. Man bringt einen Wirkstoff in die Zelle ein und hofft auf eine positive Reaktion. In den unglaublich aufwendigen Screening-Prozessen werden auf diese Weise Millionen von Wirkstoffen auf ihre Wechselwirkung mit bestimmten Proteinen untersucht. Wenn die gewünschte Reaktion eintritt, kann auf Basis des gefundenen Wirkstoffes ein Arzneistoff entwickelt werden, aber es wurde nicht verstanden, warum die Reaktion eingetreten ist. Das ist der Grund, warum viele Arzneistoffe eine lange Liste von Nebenwirkungen haben. Wir haben die Hoffnung, mit unserem System META dazu beizutragen, Klarheit in das Ursachenverständnis von Krankheiten zu bringen, damit sehr viel früher als bisher reagiert werden kann. Der Weg dahin führt über das Erkennen der Wechselwirkungen der Proteine, die an den Fehlfunktionen eines Organismus beteiligt sind. Wenn ich weiß, da gibt es eine genetische Veranlagung, die darauf hinweist, dass dieser Mensch vielleicht an dieser oder jener Krankheit leiden wird, kann man anhand dieses Musters bereits vor Ausbrechen der Krankheit entscheiden, ob dieser Patient beobachtet oder vielleicht sogar schon behandelt werden sollte. Ist die Krankheit ausgebrochen, kann ich genau an den verantwortlichen Proteinen mit ganz spezifischen Arzneistoffen ansetzen und auf die Art und Weise viel intelligenter therapieren. Wir glauben, dass man mit diesem Mikroskop in eine ganz neue Dimension von Krankheitsursachen-Analytik, aber auch Therapie kommt. Denn das Krankheitsursachen-Verständnis ist der Schlüssel zur nächsten Phase der Evolution in der Medizin.
Gibt es dazu schon Erfolgsmeldungen? Haben Sie Feedback von Ihren Kunden?
Dr. rer. nat. Bernhard Zimmermann
Wir haben mittlerweile mehrere hundert Systeme im Einsatz. Die Geräte stehen in Labors, die in Bereichen von genuiner Grundlagenforschung bis hin zur Krebsforschung arbeiten. Gerade letzte Woche haben wir wieder eine sehr positive Rückmeldung aus einem Krebsforschungslabor in den USA bekommen, in dem es zum ersten Mal gelungen ist, fünf markierte Proteine in ihrem biologischen System gleichzeitig nachzuweisen. Bis vor kurzem war das absolut undenkbar.
Diese Technologie wurde in Zusammenarbeit mit der NASA entwickelt. Geschah dies nur im Vorfeld, oder ist das ein engerer Prozess gewesen? Das Zweite: Wie ist der Entwicklungsprozess im Unternehmen abgelaufen? War es eine wissenschaftliche Entwicklung des Teams, oder hat man im Unternehmen einen Markt erkannt und bewusst dorthin entwickelt?
Dipl.-Phys. Ralf Wolleschensky
Ich greife mit der Beantwortung der zweiten Frage einmal vor. Das ist durchaus eine Aktivität gewesen, die aus der Mannschaft kam. Wir beobachten die wissenschaftliche Community sehr intensiv, vor allem die in den USA, weil die USA unser wichtigster Markt sind. Fast 50 Prozent unserer Laser Scanning Mikroskope vertreiben wir dort. Der Grund dafür ist, dass die Forschung und die wesentlichen Entdeckungen häufig in US-amerikanischen Forschungslabors starten, bevor sie dann nach Europa oder in den asiatischen Bereich überschwappen. Insofern haben wir ein sehr dichtes Netzwerk mit den wichtigsten Universitäten in den USA. Eine davon ist CalTech, das California Institute of Technology. Ein Team von Carl Zeiss hat teilweise vor Ort Schritt für Schritt gemeinsam mit Forschern von CalTech und JPL die Technologie entwickelt. Das geschah in ganz kurzer Zeit. Es war faszinierend, dass wir 18 Monate nach Entwicklungsbeginn am Markt waren. Das hätten wir ohne externe Partner nicht geschafft.
Dr. rer. nat. Bernhard Zimmermann
Ein zusätzlicher Erfolg war, dass wir den technologischen Ansatz so wählen konnten, dass alle unsere Kunden, die bereits über die Geräteplattform eines Laser Scanning Mikroskops verfügten, die Neuentwicklung auch noch nutzen können. Diese Kunden können heute ihre Systeme problemlos mit META nachrüsten.
Ganz konkret: Wie passiert so etwas? Sie reden mit den Leuten, dann gehen Sie nach Hause und nehmen das Päckchen an Aufgaben mit? Wie groß war das Team, das an dieser Fragestellung gearbeitet hat, und was für Qualifikationen waren dort versammelt?
Dipl.-Phys. Ralf Wolleschensky
Meine Aufgabe war es, aus dem Technologieportfolio die richtige Technologie herauszunehmen und zu sagen, mit den drei, vier, fünf Ansätzen könnten wir erfolgreich sein. Am Anfang waren wir eine sehr kleine Gruppe. Als Projektleiter wurde ich begleitet von einem Konstrukteur und einem Optikrechner sowie von einem Elektroniker und einem Softwerker. Dieses Team hat zunächst einmal die Aktivitäten im Haus betreut und das Thema vorangetrieben. Wir haben dann mit Applikationspartnern - denn es ging ja um das ganz konkrete Lösen des Problems des Kunden in den USA - direkt im Forschungsumfeld eine lange Zeit, über ca. 8 Monate, zeitweise vor Ort im Labor, zusammengearbeitet. Die eigentliche Umsetzung der Hardware und Software erfolgte innerhalb von Carl Zeiss in Jena. Die Forscher an den Jet Propulsion Laboratories und am CalTech standen uns beratend zur Seite, und das war das Entscheidende, insbesondere dann, wenn es sich um kritische Fragestellungen handelte. Beispielsweise ging es um die Algorithmen: Wie kann man die Berechnungen eigentlich in Echtzeit durchführen? Das sind sehr aufwendige Algorithmen. Hier konnte man wieder in das Technologie-Portfolio von JPL greifen und sagen: Okay, das sind die Wege, die in Richtung Echtzeit gehen. In einer ersten Studie wurden zwei Geräte aufgebaut. Ein Gerät im Forschungsumfeld diente zur Klärung der Fragestellung "Haben wir das richtig gemacht?". Wir wollten natürlich mit der Technologie noch nicht direkt an den Markt gehen. Die Praxistauglichkeit hatten wir praktisch in "Hinterzimmeraktivitäten" mit vertraulichen Einladungen getestet und haben Spezialisten, die weltbesten Forscher, zu kleinen Workshops eingeladen und ihnen präsentiert, wo wir stehen. Wir haben sie direkt an den Geräten experimentieren lassen. Die waren hin und weg. Im Verlauf der Entwicklung zu einem marktfähigen Produkt stießen immer mehr Leute dazu, z. B. diejenigen, die das Projekt in die Fertigung überführen sollten. Beteiligt waren dann Fertigungsingenieure, Patentspezialisten und Serviceleute. Insofern waren wir dann am Schluss ein etwa 40 Personen starkes Team.
Die Technologie ist bereits in ein erfolgreiches Produkt umgesetzt worden und seit 2001 am Markt. Wie sieht dieser Markt insgesamt aus, wie sehen Sie selbst Ihre Erfolgschancen? Welche Weiterentwicklungen gibt es?
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Wir sind, zumindest im Schwerpunkt, noch ein Instrumentenlieferant. Wir wissen, dass das für die Zukunft nicht ausreichen wird, weil wir im Marktumfeld eine Veränderung sehen. Die Mikroskopie ist heute ein Tool wie im Baumarkt der Hammer. Sie ist eine sehr flexibel und vielseitig einsetzbare Technologie. Wir glauben aber, dass die Zukunft in konkreten Lösungen für spezifische Applikationen liegt. Wir haben mit dem LSM 510 META gezeigt, dass das der richtige Weg ist. Beim LSM 510 META haben wir sehr gut verstanden, was der Kunde tatsächlich braucht, und das war eben nicht nur ein einfacher Hammer, sondern es ging um die Peripherie, die notwendig ist, um ein konkretes Problem zu lösen. Sie sehen einen Werkzeuglieferanten sich transformieren in ein Unternehmen, das spezifische Problemstellungen mit Lösungen bedient. Deswegen ist die Marktdefinition nicht ganz so einfach. Wenn ich mal die "alte Welt" beschreibe, dann beläuft sich der Instrumentenbereich Mikroskopie in der Größenordnung 1,5 Milliarden Euro. In diesem Segment haben wir unseren entsprechenden Anteil. In der Laser Scanning Mikroskopie sind wir Marktführer, was wir mit Stolz zum Ausdruck bringen können.
Stichwort Fertigung: Wird in Jena gefertigt und in den USA?
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Wir fertigen in Deutschland, und dazu muss man in die Historie gehen. 1995, nach der Wiedervereinigung Deutschlands, wurde die Mikroskopie von Carl Zeiss an einem Standort zusammengeführt. Vorher gab es Aktivitäten in Oberkochen, dem "West-Headquarter" - mit der Produktion von Laser Scanning Mikroskopen in Göttingen -, und hier in Jena, dem "Ost-Headquarter". Man hat im Januar 1995 die Mikroskopieaktivitäten in Jena konzentriert, hat aber die Fertigung der Laser Scanning Mikroskope in Göttingen belassen. Göttingen ist mittlerweile keine Fabrik mehr, sondern betreut ein komplettes Geschäft, und zwar das der traditionellen Mikroskope: Fertigung, Leitung, Forschung, Entwicklung, Produktmanagement und Sales. Das Geschäft der komplexen Mikroskopsysteme und das Pharmascreening sind inzwischen als vollstufige Geschäfte in Jena angesiedelt. Wir haben dann diesen enormen Boom, den das LSM 510 META im Markt auslöste, zum Anlass genommen, eine zweite Fertigungslinie in Jena aufzubauen.
Sie haben eben ein Stichwort gegeben: "Anbieter kompletter Lösungen am Markt". Gibt es dazu konkrete Pläne und wenn ja, wie sehen diese aus?
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Wir setzen uns natürlich mit einer langfristigen Strategie auseinander und denken durchaus über die nächsten fünf Jahre hinaus. Der Schritt zum Anbieter von Komplettlösungen ist für Carl Zeiss sicher ein gewaltiger Schritt und wird für uns ein nicht immer ganz einfacher Weg sein, aber wir gehen ihn mutig an. Bei der Laser Scanning Mikroskopie sind wir durch Aktivitäten wie das LSM 510 META auf diesem Pfad schon ein Stückchen weiter vorangekommen.
Ein Kriterium der Nominierung zum Deutschen Zukunftspreis ist das der Innovation, das Ihrem Projekt und Produkt zugeordnet wird. Was ist Innovation für Sie?
Dr. rer. nat. Bernhard Zimmermann
Innovation hat für mich ein Stück weit mit dem Unerwarteten und seinem Erfolg beim Adressaten zu tun. Beides trifft auf das LSM 510 META zu: Unsere Kunden haben das nicht erwartet; der Weg war nicht vorgezeichnet. Das Projekt war für uns auch insofern eine spannende Geschichte, als wir nicht exakt vorhersehen konnten, wie schnell das Verfahren akzeptiert wird in einem Markt, der einerseits zwar auf Innovationen angewiesen ist, der für sich in Anspruch nimmt, hochinnovativ zu sein, der auf der anderen Seite aber auch sehr konservativ ist, weil er von Beweisführungen lebt. Ich glaube, für mich beschreibt es das: Die Sache darf nicht ausrechenbar sein und muss sich durchsetzen.
Dipl.-Phys. Ralf Wolleschensky
Man muss unterscheiden zwischen technischen Innovationen und den Innovationen, die dann der Kunde als Innovation auch für sich sieht. Für mich war die Innovation schon, dass der Kunde seine Arbeiten, seinen Arbeitsablauf, wesentlich vereinfachen konnte. Stellen Sie sich vor, dass ein Forscher das Embryowachstum von Tieren über eine Woche lang beobachtet und dabei immer nur auf einen Farbstoff schaut. In der nächsten Woche nimmt er den nächsten Embryo, schaut ihn sich mit einer anderen Farbe an und versucht jetzt, diese Signale zu korrelieren. Das ist zum einen ein sehr großer zeitlicher Aufwand, und zum anderen ist es sehr schwierig, die Daten miteinander zu korrelieren. Genau das ist dem Kunden nun ermöglicht worden: Er kann sich mehrere Vorgänge simultan anschauen und in der gleichen Zeit eine Fülle von Informationen generieren, die er vorher nicht erzeugen konnte. Insofern ist das für den Kunden die neue Herangehensweise. Das ist für den Kunden die Innovation gewesen.
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Für mich ist Innovation definitiv etwas, was in der Applikation beim Kundennutzen anfangen muss. Es geht nicht darum, technische Spitzenleistungen nur der Spitzenleistung wegen zu erbringen, sondern es muss ganz klar sein, dass Innovation beim Kunden einen Nutzen hinterlässt. Das ist der eine Punkt. Innovation setzt ein tiefes Verständnis der Kundenapplikation voraus, um genau die Hürde zu verstehen, die der Kunde in seinen Abläufen hat und die man überspringen muss, um wirklich beim Kunden eine signifikante Veränderung in seinen Prozessen erreichen zu können. Es ist sicher etwas dran an diesem Moment des Überraschenden; auf der anderen Seite glaube ich genauso daran, dass Innovation zwar nicht unbedingt programmierbar, aber zumindest doch systematisierbar ist. Ich glaube, Innovation ist nicht nur das, was einem geschieht, sondern auch, was man mit einer gewissen Systematik ableiten kann. Das versuchen wir in der Tat auch aus dem LSM 510 META heraus für uns zu systematisieren.
Was hat Sie eigentlich seinerzeit zu Ihrem Studium gebracht? Wer oder was hat Sie bisher in Ihrem Leben besonders beeindruckt, geprägt oder ermutigt, Ihren Weg weiterzugehen?
Dr. rer. nat. Bernhard Zimmermann
Ich bin studierter Biologe. Der Weg dorthin geht zurück bis in die Schulzeit. Grundsätzliches Interesse an der Biologie entwickelte sich dann am Gymnasium im Leistungskurs Biologie. Dann überlegt man sich im Studium: Welche Teildisziplin ist die spannendste? Mich faszinierte zu Beginn meines Studiums dann speziell die Genetik; ich wollte wissen, wie die Evolution funktioniert, wie der Bau eines Organismus vonstatten geht. Letztendlich bin ich dann in die Zellbiologie und die Physiologie "gerutscht" und habe sehr viel mit optischen Systemen gearbeitet. Eines der Instrumente war das LSM 510 von Zeiss und eine ganz andere Reihe von Mikroskopbasierten Aufbauten, so dass ich dann vor gut drei Jahren, nach meiner Doktorarbeit, einem Postdoc-Aufenthalt in den USA und nach drei Jahren Forschungstätigkeit in Deutschland, mich vor der Entscheidung sah, entweder den akademischen Weg weiterzuverfolgen oder in die Industrie zu wechseln. Zurückblickend kann ich sagen, dass es eine absolut richtige Entscheidung war, nach Jena zu kommen, weil es einerseits für mich jetzt diesen instrumentellen Aspekt gibt, der mich immer schon interessiert hat. Auf der anderen Seite bin ich immer noch in der Biologie und treffe Kunden, mit denen ich nach wie vor auf hohem Niveau reden kann.
Dipl.-Phys. Ralf Wolleschensky
Ich bin von der Ausbildung her Physiker. Der Grund, warum ich mich für die Physik entschieden habe, lag primär darin, dass ich mich schon von Kindesbeinen an mit Dingen beschäftigt habe, wo es etwas zu basteln gab oder wo es darum ging, bestimmte Mechanismen zu verstehen. Von daher war schon das Interesse da, in diese Richtung zu gehen. Ich konnte mein Abitur an einer Spezialschule mit naturwissenschaftlich-technischer Ausrichtung machen, wo dies natürlich noch verstärkt wurde. In Jena an der Friedrich-Schiller-Universität habe ich dann Physik studiert und bin während des Studiums ein Jahr nach England gegangen. Prof. Sauerbrey von der Jenaer Universität bot mir im Anschluss an den England-Aufenthalt die Möglichkeit, hier bei Zeiss meine Diplomarbeit zu machen. Betreut wurde ich dabei von Herrn Dr. Simon. Insofern war er dann auch ausschlaggebend dafür, dass ich mich für Zeiss entschieden habe. Insbesondere lag es daran, dass das Arbeitsfeld sehr vielseitig und durch eine Vielzahl von Kontakten mit Universitäten geprägt war.
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Bei mir war es mit an Sicherheit grenzender Wahrscheinlichkeit mein Physik-Leistungskurslehrer. Die Art und Weise, wie er uns für Physik begeistert hat, war einfach phänomenal. Der Jahrgang hatte eine noch nie da gewesene Physik-Leistungskurs-Quote. Der Mann hat es einfach verstanden, uns als junge Menschen an Fragestellungen heranzuführen und unsere Neugier zu wecken. Ich habe in Bonn studiert und bin nach meiner Promotion in die USA an die Rice University gegangen, das ist eine kleine Privatuniversität in Texas. Das war ein weiteres prägendes Ereignis für mich. Der Mann, der mich damals an die Universität geholt hat, Bob Curl, hat mittlerweile den Nobelpreis für die C60 Buckyballs (Fullerene) bekommen, die heute in Nano-Strukturen ganz intensiv eingesetzt werden. Er hatte sich einen "Copiloten" an Bord geholt, einen Mann von General Electrics. Der kam aus dem Management, war selbst auch promovierter Physiker, hatte in Oxford studiert, war bei General Electrics und kam dann zur Rice University. Der Mann war ein knallharter Manager. Dieses Spannungsfeld war hochinteressant: auf der einen Seite die absolut anspruchsvolle Wissenschaft und auf der anderen Seite die Managementfähigkeiten. Als ich Physik studierte, wollte ich eigentlich in die Lehrerausbildung, Hochschulausbildung, Hochschulkarriere hinein. Ich habe in Deutschland, als ich dann nach diesen drei Jahren die Möglichkeit hatte bei Zeiss anzufangen, noch mal lange darüber mit meinem betreuenden Professor Wolfgang Demtröder in Kaiserslautern diskutiert. Wir haben viele Nächte lang beraten, was jetzt der richtige Weg ist: die Academia oder die Industrie? Das Problem bei der Industrie ist natürlich, dass man zu einem bestimmten Zeitpunkt einsteigen muss. Ich war damals 31, das war der richtige Zeitpunkt um einzusteigen, und Demtröder sagte: "Wenn du später in die Academia willst, das geht dann immer noch; umgekehrt geht es nicht." Und ich muss ganz ehrlich sagen, den Weg habe ich nicht bereut.
Was gibt es denn bei Ihnen außerhalb der Mikroskope noch? Was tun Sie als private Menschen?
Dr. rer. nat. Bernhard Zimmermann
Ich habe eine Tochter; sie beansprucht die Wochenenden zum großen Teil, und wenn dann noch Zeit bleibt, dann fahre ich hier gern mit dem Fahrrad über die Hügel. Wenn es ein bisschen weiter reicht, fahre ich in den Süden in die Alpen, bergsteigen, Ski laufen.
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Mountainbiking ist eine Leidenschaft, die wir drei teilen. Ich glaube, das kommt durch die Region Jena; dieses Profil von Jena ist einfach fantastisch. Wir haben auch die eine oder andere Tour gemeinsam bestritten.
Dipl.-Phys. Ralf Wolleschensky
Dem brauche ich auch gar nichts weiter hinzuzufügen, außer dass es bei mir kein Kind gibt. Ich verwende einen Großteil meiner Freizeit dafür, mich sportlich zu betätigen, vor allem mit Mountainbiking und Wandern.
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Ich treibe so viel Sport, wie es nur irgend geht. Ich habe eine kleine Tochter, eine kleine Amerikanerin, auf die ich auch sehr stolz bin. Darüber hinaus habe ich immer sehr viel Musik gemacht; ich bin in einer musikalischen Familie aufgewachsen und spiele das eine oder andere Instrument. Aber dazu schließe ich meistens die Tür und mache das alleine. Das ist eine fantastische Art für mich, einfach auszuspannen und abzuschalten.
Was spielen Sie für Instrumente?
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Klavier, Keybord, Gitarre, E-Gitarre. Je nachdem, wie viel Energie man loswerden muss, kommt dann eben das eine oder das andere Instrument zum Einsatz.
Was wünschen Sie sich für die Zukunft?
Dr. rer. nat. Dipl.-Phys. Ulrich Simon
Wenn wir von der Firma und der Richtung für die Zukunft sprechen, glaube ich, haben wir durchaus an mancher Stelle noch Nachholbedarf. Zum anderen haben wir gerade in diesen Tagen eine wichtige Strategierunde abgeschlossen. Der Vorstand hat uns wissen lassen, es war die beste Strategiepräsentation seit Jahren. Darauf sind wir sehr stolz. Das gibt uns den Mut und den Ansporn, jetzt in die Umsetzung zu gehen. Ich wünsche mir, dass ich so lange dabeibleiben kann, wie es geht. Dass wir alle unsere Kraft mit einbringen und mitgestalten können. Ich glaube, dass wir eine der spannendsten Entwicklungen in der Mikroskopie vor uns haben.
Dipl.-Phys. Ralf Wolleschensky
Ich wünsche mir, dass wir auch in Zukunft weiterhin in diesem Team so eng zusammenarbeiten, denn wir verstehen uns nicht nur im Arbeitsfeld, sondern auch privat.
Dr. rer. nat. Bernhard Zimmermann
Das ist in diesem Hause mit Sicherheit ein wichtiger Aspekt, den ich mir auch für die Zukunft wünsche. Ich wünsche mir darüber hinaus, dass ich selbst den Spagat zwischen der Biologie auf der einen und den Marketingfokussierten Themen auf der anderen Seite weiter bewerkstelligen und meinen Level in der Biologie so lange so hoch wie möglich halten kann. Das ist nicht ganz einfach, weil die Biologie ein hochdynamisches Feld ist, aber meines Erachtens sehr wichtig, zumindest in meiner jetzigen Position.
_____________
1) Human Genome Organisation, 1998 in den USA gegründet, daraus entstand das Human Genome Project (HGP).



 Gebärdensprache
Gebärdensprache
 Leichte Sprache
Leichte Sprache