Prof. Dr. rer. nat. Thomas Flohr
Ein Computertomograph (CT), wie er lange schon und bisher üblich ist, ist ein medizinisches Bildgebungsgerät. Es erstellt Schichtbilder der Anatomie des Patienten, im Wesentlichen stellt es Organe dar. Viele technische Entwicklungen in den letzten Jahren gingen dahin, diese Organe immer schärfer mit immer besserer Auflösung abzubilden und auch bewegte Organe ruhiger darzustellen, sodass man letztendlich sogar das Herz bewegungsfrei abbilden konnte. Aber diese Verbesserungen waren limitiert. Die erreichbare Detailgenauigkeit eines konventionellen CT ist begrenzt, sie hat einen gewissen Sättigungsgrad erreicht, die Bildgebung ist eine rein anatomische. Und das ist oft nicht genug, eine CT-Untersuchung als solche nicht allein aussagekräftig. Sie kann zwar darstellen, dass etwas vorhanden ist – ein Tumor in der Leber oder eine Problematik in den Herzkranzgefäßen. Aber die Computertomographie kann nicht darstellen, was das letztendlich für den Patienten bedeutet, sodass sich oft Folgeuntersuchungen anschließen müssen, um für den Patienten klinische Informationen zu bekommen, die auch seine Behandlungen bestimmen und beeinflussen können.
Wenn ich das technisch definiere, kennzeichnet ein CT die Detailgenauigkeit, mit der man ein Organ abbilden kann. Das bezeichnet man technisch als räumliche Auflösung. Je kleinere Details man darstellen kann, desto besser oder höher ist die räumliche Auflösung. Hier ist ein herkömmliches CT prinzipbedingt limitiert. Ein zweiter Punkt bei einem herkömmlichen CT ist: Man muss, um ein bestimmtes Untersuchungsergebnis zu bekommen, eine bestimmte Strahlendosis aufwenden. Die Möglichkeit, die Strahlendosis zu reduzieren, hat man in den letzten Jahren sehr intensiv untersucht. Das hat durchaus große Fortschritte gebracht, ist aber auch an einer Sättigung angelangt. Mit dem herkömmlichen CT-Prinzip ist es nicht möglich, die Strahlendosis für den Patienten signifikant weiter zu reduzieren. Und der dritte Punkt ist: Ein herkömmliches CT hat aufgrund seines Messprinzips bisher nur global die Röntgenschwächung der einzelnen Organe messen können. Es kann aber keine chemischen Unterschiede feststellen, zumindest nicht im routinemäßig angewandten klinischen Modus. So kann es durchaus sein, dass verschiedene Organe wie Knochen, die aus Kalzium bestehen, oder Gefäße, die mit Kontrastmittel gefüllt sind – meist ist es jodhaltiges Kontrastmittel –, eine sehr ähnliche Röntgenschwächung haben. Auf einem konventionellen CT-Bild werden sie deswegen gleichartig dargestellt, obwohl sie natürlich chemisch völlig verschieden sind.
Dr. rer. biol. hum. Stefan Ulzheimer
Lassen Sie uns zusätzlich einen Blick auf die Schlüsselkomponenten werfen, aus denen ein CT besteht. Das trägt sicher zum Verständnis bei, an welcher Stelle wir jetzt diesen Durchbruch erreicht haben. Ein konventionelles CT-System besteht aus einer Röntgenröhre auf der einen Seite und einem Detektorsystem auf der anderen. Die Gantry-Mechanik lässt diese beiden Schlüsselkomponenten um den Patienten herum rotieren, um überlagerungsfreie 3D-Datensätze vom menschlichen Körper zu erstellen. Unsere Innovation konzentriert sich auf die Detektorseite. Wir haben einen Detektor entwickelt mit einem revolutionär neuen Prinzip.
Prof. Dr. rer. nat. Thomas Flohr
Man darf sich das allerdings nicht so vorstellen: Man nimmt ein bestehendes konventionelles CT, baut den alten Detektor aus, einen neuen ein – und alles ist gut! Dieser neue Detektor bedingt innovative Neuentwicklungen des gesamten CT-Systems.
Ihr neuer Ansatz, der jetzt zum Tragen kommt, hat eine längere Entwicklungszeit benötigt. Warum hat das lange gedauert? In welchen Schritten hat sich das vollzogen und wo gab es auch Schwierigkeiten?
Prof. Dr. rer. nat. Thomas Flohr
Die Entwicklung basiert auf Arbeiten von fast 20 Jahren. Der „Knackpunkt“ war die Entwicklung des Detektors, diese Komponente hat uns am längsten beschäftigt.
Dr. rer. nat. Björn Kreisler
Das herkömmliche Detektormaterial wandelt Röntgenlicht in sichtbares Licht um, das man dann mit einer Fotodiode, ähnlich einer Digitalkamera aufnimmt. Unser neues Detektormaterial ermöglicht die direkte Umwandlung von Röntgenstrahlen in ein elektrisches Signal, das weiterverarbeitet werden kann. Und dieser Umwandlungsprozess im Sensor hängt sehr stark mit der Sensorqualität, also der Kristallqualität unseres Sensors zusammen. Diese Qualität ist erst in den letzten 20 Jahren in intensiver Entwicklung auf ein Niveau gehoben worden, das es erlaubt, eine große Detektorfläche gleichmäßig gut ausstatten zu können, um so die Bilddaten aufnehmen zu können.
Sie nutzen Cadmium-Tellurit als Material für den Detektor. Welche Entwicklungsschritte waren das?
Prof. Dr. rer. nat. Thomas Flohr
Das hat gedauert, 20 Jahre – das ist schon wesentlich länger als ein herkömmliches CT-Gerät in der Entwicklung braucht. Damit ist man in der Regel in drei, vier Jahren fertig. Seit Anfang der 2000er Jahre hat man die Möglichkeiten erforscht, die dieses neue Detektormaterial, Cadmium-Tellurit, bieten könnte; die grundsätzlichen Vorteile im Vergleich zum konventionellen Detektor wurden relativ schnell erkannt. Allerdings waren die ersten Detektormaterialien, die man damals zur Verfügung hatte, nicht geeignet, um sie in einem medizinischen CT in der klinischen Routine einzusetzen. Das Material war nicht homogen genug, man konnte damit keine größeren Detektorelemente bauen, weil es zeitlich instabil war. Das äußert sich auf CT-Bildern in dem, was wir Artefakte nennen: in Strukturen, die nichts mit der Anatomie des Patienten zu tun haben, die plötzlich unvorhersehbar auftauchen und letztendlich die Bilder unbrauchbar machen. Es ging auch um ganz prinzipielle Eigenschaften. Eine CT-Aufnahme ist mit einer bestimmten Strahlendosis für den Patienten verbunden. Die ist zwar bei modernen CTs nicht mehr hoch, aber die Cadmium-Tellurit-Materialien zur damaligen Zeit konnten diese Strahlendosis nicht tolerieren und haben verfälschte Messwerte geliefert. Daher galt Cadmium-Tellurit als ein Material, das potentiell sehr gute Eigenschaften hatte, aber eigentlich zur damaligen Zeit für eine Routine der klinischen Anwendung unbrauchbar war. Und so ist das Schritt für Schritt weiterentwickelt worden – mit allen Höhen und Tiefen. Ich habe das von Anfang an miterlebt und kann mich auch an Zeiten erinnern, wo wir gesagt haben: Leute, das wird nie was, gebt das auf. Das bekommen wir nicht in einen Zustand, dass es jemals für ein medizinisches CT brauchbar ist. Wir haben uns aber damals entschieden, weiterzumachen und haben letztendlich einen Zustand des Materials erreicht, mit dem wir in einem CT-Gerät in der klinischen Routine arbeiten können: Das ist die wesentliche Leistung an dem Projekt. Nun wird man sagen, dass es diese quantenzählenden Detektoren, dieses Cadmium-Tellurit schon lange gibt. Dazu gibt es hunderte Veröffentlichungen. Naja, aber alle sind behaftet mit diesen negativen Eigenschaften, die dafür sorgten, dass man dieses Detektionsprinzip bisher nur in experimentellen Röntgengeräten, nur für die Kleintier-Bildgebung nutzen konnte – aber nicht für ein routinetaugliches CT am Menschen. Und das ist die wesentliche Leistung, die wir hier vollbracht haben.
Dr. rer. nat. Björn Kreisler
2008 gab es die ersten Prototypen mit dem neuen Detektor, das waren noch Laborprototypen. Und ab 2014 erfolgten die ersten Einsätze am Patienten.
Kommen wir zu Ihrer Innovation. Erläutern Sie uns doch bitte, was diese grundsätzlich bedeutet, bevor wir auf die einzelnen Komponenten eingehen.
Dr. rer. biol. hum. Stefan Ulzheimer
Lassen Sie mich das sehr vereinfacht sagen: Diese Entwicklung entspricht der vom niedrigauflösenden schwarz-weißen Fernseher zum hochauflösenden Farbfernsehen. Da ist man, um im Vergleich zu bleiben, heute mit unserer neuen CT-Technologie. Das hinkt ein wenig, aber es deckt diese zwei Bereiche ab: Das sind technische Vorteile, zum einen die deutlich erhöhte Auflösung im Bild, die in der Medizin tatsächlich einen klinischen Vorteil bietet und neue Einblicke in den menschlichen Körper ermöglicht. Und zum anderen ist es die neue Dimension der Daten als farbige Information. Und das nicht nur als Bildeindruck, sondern als echte Zusatzinformation. Man kann in der CT bereits heute durch spezielle Techniken zwei Farben als zusätzliche Dimension in den Bilddaten kodieren, die damit in der Lage sind, nicht nur Anatomie abzubilden, sondern auch funktionelle Ergebnisse wie Jodkonzentrationen, die dann wiederum mit dem Metabolismus im Körper korrelieren. Konkret gehen die Daten, die CTs künftig liefern können, in mehreren Dimensionen über das hinaus, was wir derzeit haben. Zum einen ist das eine deutlich höhere räumliche Auflösung, und zum andern sind es Zusatzinformationen durch mehrfarbige Daten (in unserem Fall sind es vier Farben), die Materialinformationen, Kontrastkonzentrationen im menschlichen Körper liefern.
Für diese neuen Funktionen wurde das Gerät auch in der Struktur verändert?
Prof. Dr. rer. nat. Thomas Flohr
Das Gerät ist anders aufgebaut und hat diesen andersartigen Detektor, der als quantenzählender oder auch photonenzählender Detektor bezeichnet wird. Was bedeutet das? Dazu müssen wir ein wenig in die Physik einsteigen: Röntgenstrahlen, wie auch sichtbares Licht, kann man sich als Strom von kleinen Energiepaketen, kleinen Teilchen vorstellen. Das sind die sogenannten Photonen oder Quanten. Sehr vereinfacht: Licht ist so etwas wie Regen aus einer Gießkanne und die einzelnen Tropfen, das sind die einzelnen Lichtquanten. Beim Röntgenlicht ist es ebenso, da sind die einzelnen Tropfen Röntgenquanten. Ein herkömmlicher Detektor kann nur die Summenwirkung dieser Quanten aufnehmen, so, wie wenn man mit einer Gießkanne Wasser in einen Eimer gießt. Und was letztendlich ein herkömmlicher Detektor daraus übermitteln kann, ist, wie viel Wasser im Eimer ist: z. B. dass sich drei Liter Wasser im Eimer befinden. Ein quantenzählender Detektor kann stattdessen jeden einzelnen dieser Tropfen zählen und kann zu jedem einzelnen dieser Tropfen bzw. dieser Energiepakete übermitteln, wie groß es eigentlich war. Ein photonenzählender Detektor kann also feststellen, dass im Eimer drei Liter Wasser sind, und dass diese aus 197.000 Regentropfen entstanden sind; dabei waren 85.000 dieser Regentropfen klein, 30.000 waren mittelgroß und 20.000 waren besonders groß. Das ist der wesentliche Unterschied.
Dr. rer. nat. Björn Kreisler
Nass wird man auch durch kleine Tropfen, aber es macht für das Signal, also für den Bildkontrast, den ein Patient liefert, einen großen Unterschied, ob eben ein Röntgenquant mit einer großen Energie oder viele Röntgenquanten mit kleiner Energie gemessen werden.
Kommen wir auf Cadmium-Tellurit als neuen Detektorwerkstoff zurück. Wie muss man sich das als Laie vorstellen, was bewirkt das Cadmium-Tellurit?
Dr. rer. nat. Björn Kreisler
Ich fange beim herkömmlichen System an. Das hat einen Szintillator, sprich ein Material, das unter Röntgenstrahlung anfängt zu leuchten. Es ist wie eine Fotoscheibe, bei der man feststellen kann, was wie schwarz geworden ist. Und dann misst man in kurzen Zeitabständen, wie schwarz diese Folie ist. Wenn man die Analogie zur Fotografie wählt, hat man da bisher ein Foto gemacht und hat dann ausgewertet, was drauf war. Jetzt können wir die ganze Zeit nachschauen, wie viele einzelne Röntgenquanten in einem einzelnen Pixel ankommen. Das passiert dadurch, dass eben nicht mehr eine Fotoscheibe geschwärzt wird, sondern wir einzelne Signale direkt umsetzen: Jedes Röntgenquant erzeugt ein elektrisches Signal, das wir messen oder vermessen können. Und dadurch lässt sich eine Signalhöhe und eine Pulsanzahl vermessen. Also nicht mehr die simple Schwärzung einer Fotoplatte, sondern Anzahl und Höhe der Signale.
Dr. rer. biol. hum. Stefan Ulzheimer
Aber vielleicht hilft es hier auch, die Aufgabe des Detektors im Zusammenspiel zu erläutern. Auf der einen Seite gibt es die Röntgenröhre, die davon ausgehende Röntgenstrahlung wird durch das Objekt, das ich untersuche, geschwächt. Das ist in unserem Fall bei einem Medizinprodukt der Mensch. Eine gewisse Anzahl an Röntgenquanten bleibt im Körper stecken und diese Anzahl hängt davon ab, wie dicht der Körper an der Stelle ist, und welches Material dort vorhanden ist. Unterschiedliche Materialien schwächen die Röntgenstrahlen verschieden stark. Und aus diesem Bild, sozusagen hinter dem Patienten, berechnet der Computertomograph einen 3D-Bilddatensatz. Der Detektor hat die Aufgabe, möglichst alle Quanten der Röntgenstrahlung, die noch durch den Patienten durchkommen, zu absorbieren und dann in ein elektrisches Signal zu verwandeln. Und herkömmliche Detektoren arbeiten eben mit diesem zweistufigen Prinzip: Erst Szintillator, sichtbares Licht, dann Fotodioden wie in einer Digitalkamera. Unser neuer Detektor kann die Röntgenquanten, die nach Durchqueren des Patienten bei ihm ankommen, direkt in ein elektrisches Signal verwandeln und damit diese Zusatzinformation gewinnen, die Thomas Flohr beschrieben hat.
Prof. Dr. rer. nat. Thomas Flohr
Durch das Weglassen eines störenden und verfälschenden Schrittes hat man ein besseres, schärferes Bild mit mehr Informationen und erhält gleichzeitig Zugang zu den Informationen, die wir genannt haben. Der Detektor ist die einzige Möglichkeit, wirklich all diese Informationen gleichzeitig zu bekommen. Nun könnte man sagen, dass man in der CT auch herkömmliche Detektoren unter Inkaufnahme einer höheren Dosisbelastung für den Patienten so strukturieren könnte, dass sie schärfere Bilder liefern; auch mit herkömmlichen Aufnahmeprinzipien dafür sorgen könnte, dass man diese funktionellen Informationen mit gewissen Einschränkungen bekommt. Es gibt Aufnahmetechniken, die z. B. mit verschiedenen Spannungen der Röntgenröhre, mit verschiedenen Spektren arbeiten und so Zusatzinformationen liefern. Man bekommt aber nie alle Vorteile gleichzeitig. Wenn man in dem ersten Vergleich bleibt und mit einem grob pixeligen Schwarz-Weiß-Bild beginnt, dann liefert ein photonenzählender Detektor ein HD-Farbbild. Herkömmliche Detektoren können vielleicht aus diesem grob pixeligen Schwarz-Weiß-Bild ein Farbbild machen. Das bleibt aber genauso grob pixelig. Oder sie könnten das Bild etwas schärfer machen, aber dann bleibt es schwarz-weiß. Aber das alles zusammenzubringen, das ist sozusagen die Leistung!
Dr. rer. nat. Björn Kreisler
Was im Moment mit den herkömmlichen Systemen machbar ist, ist, mehrere Schwarz-Weiß-Bilder einzufärben. Und jetzt können wir direkt ein Farbbild messen.
Diese Ergebnisse erzielt man in Ihrer Innovation mit zwei Röntgenquellen und wir haben zwei Detektoren. Was passiert über diese Doppelung?
Prof. Dr. rer. nat. Thomas Flohr
Ein herkömmliches CT hat eine Röntgenröhre und einen Detektor. Ein CT-Bild hat, damit es gut wird, letztendlich immer drei Komponenten: Einmal ist es die räumliche Schärfe, wie gut man kleine Details eines Objektes abbilden kann. Das Zweite ist die zusätzliche Komponente, die wir hineinbringen – die Farbe. Man möchte auch ein Farbbild haben. Und das Dritte ist, was man in der Fotografie Belichtungszeit nennen würde. Kurze Belichtungszeiten sind wichtig, wenn sich das Objekt bewegt, es aber trotzdem scharf sein soll. Das ist in der Computertomographie ein wichtiges Thema geworden, etwa für die Abbildung des Herzens; durch schnelle Scans auch bei Patienten, die nicht gut kooperieren können, z. B. Kinder oder in Notfallsituationen, wenn Luftanhalten ein Problem ist oder bestimmte Organbereiche sehr schnell abgebildet werden müssen. Mit einem normalen CT – mit einer Röntgenröhre und einem Detektor – kann man die Aspekte räumliche Auflösung, also wie scharf bilde ich das Objekt ab, und zusätzliche Farbbildgebung abdecken, aber nicht den Aspekt der kurzen Belichtungszeit, also eine gute zeitliche Auflösung. Dafür braucht man zwei Röhren und zwei Detektoren, also zwei Messsysteme in einer Gantry. Das ist das „Dual-Source-Prinzip“: Wenn zwei Messsysteme gleichzeitig messen, dann braucht jedes Messsystem nur halb so lang. Deswegen haben wir auch mit den quantenzählenden Detektoren das Dual-Source- Prinzip beibehalten, um alle drei Aspekte zu optimieren. Räumliche Auflösung, zeitliche Auflösung (kurze Belichtungszeiten) plus die zusätzliche Information, die Farbelemente.
Dr. rer. biol. hum. Stefan Ulzheimer
Als Mann für die einfachen Vergleiche würde ich jetzt sagen, wenn man es mit einem Fotoapparat vergleicht, entspricht das Dual-Source-Prinzip mit den zwei Röhren und zwei Detektorsystemen der Reduzierung der Verschlusszeit einer Kamera. Für Sportaufnahmen, wenn sich etwas schnell bewegt, brauche ich eine möglichst kurze Verschlusszeit, um eben keine Bewegung in den Bildern zu haben. Genau das mache ich mit Dual Source. Zusammen mit der Innovation des quantenzählenden Detektors bringt das dann eben diesen Dreiklang: höchstmögliche zeitliche Auflösung für sich bewegende Organe, räumliche Auflösung und eben die spektrale Information, die Energie.
Dr. rer. nat. Björn Kreisler
Und für die räumliche sowie spektrale Auflösung ist der Detektor die entscheidende Komponente. Räumliche Auflösung ist im konventionellen Umfeld nicht beliebig zu steigern, ohne dass man in die Strahlendosis investiert und die Dosis für den Patienten zum Teil erheblich erhöht. Höhere Auflösung kann man mit einem quantenzählenden Detektor mit sehr kleinen Pixeln dosisneutral erreichen.
Gibt es technisch gesehen weitere Spezifika dieser neuen CT-Generation?
Prof. Dr. rer. nat. Thomas Flohr
Den Detektor haben wir in ein spezielles CT-Gerät, nämlich in ein Dual-Source-Gerät, eingebaut. Aber allein mit dem Detektor ist es nicht getan, sondern die beiden Detektoren im Dual- Source-CT liefern sehr viel mehr Informationen in kürzerer Zeit. Die müssen in den Rechner transportiert werden. Dazu sind Innovationen im CT-System an sich notwendig, etwa die Datenübertragung, die eine derartig große Datenmenge in der kurzen Zeit, die die Aufnahme eines CT-Scans erfordert, überhaupt transportieren kann. Es sind völlig neuartige Datenverarbeitungstechniken und auch Bildrekonstruktionstechniken entstanden. Bei einem konventionellen Röntgengerät ist es so, dass die Röntgenröhre den Patienten durchleuchtet, dann sieht man nach, was auf dem Film abgebildet ist. Das geht bei einem CT nicht, hier nimmt man eine sehr große Datenmenge, die Rohdaten auf, die aber zunächst noch kein Bild zeigen. Dieses Bild aus dem Körper muss im Computer erst aus den aufgenommenen Daten berechnet werden. Weil diese jetzt mit dem quantenzählenden Detektor viel mehr Informationen tragen, braucht es auch neue Bildberechnungsverfahren, um die komplette Information dann im CT-Bild nutzen zu können. Dabei ist die kurze Rechenzeit ein wichtiger Faktor, denn der Arzt will im klinischen Routinebetrieb seine gewohnte Geschwindigkeit haben. Die Bilder müssen nach Beendigung der Untersuchung mit nur ganz kurzem Zeitversatz verfügbar sein. Das heißt, auch was die Rechnertechnologie angeht, mussten wir uns sehr ins Zeug legen, um einen Rechner zu bauen, der diese Datenmenge in so kurzer Zeit gut verarbeiten kann und dabei auch noch in einem vernünftigen Preisrahmen bleibt – das ist ja auch ein Aspekt eines kommerziellen CT-Gerätes. Dieses Know-how der Datenverarbeitung ist komplett hier im Haus entstanden.
Dr. rer. biol. hum. Stefan Ulzheimer
Man muss sich mal vorstellen, dass die ersten CT-Geräte noch an Kabeln rotiert haben. Das heißt, man hat immer nur eine Rotation machen können und musste dann wieder zurückrotieren. Dann funktionierte das mit Schleifringen, auch eine große Innovation in der CT Ende der 80er Jahre, um damit zum einen die Energie zum Betrieb der Röntgenröhre zuzuführen, aber auch die Daten der rotierenden CT-Gantry wieder abzuführen. Im Rahmen des jetzigen Projektes waren Kollegen damit befasst, eine komplett neue Datenstrecke zu entwickeln. Das kann man nirgends kaufen, weil es eine sehr spezielle Anforderung ist, hohe Datenmengen von einem rotierenden Gerät in einen stationären Computer zu überführen, der danebensteht. Das wurde komplett neu entwickelt und war ein eigenes großes Projekt.
Prof. Dr. rer. nat. Thomas Flohr
Die Finesse an dieser Innovation ist das Gesamtpaket. Auf der einen Seite natürlich der neue Detektor, der 20 Jahre Entwicklungszeit gebraucht hat. Aber – wie schon angemerkt, es ist nicht einfach so, dass ich den in ein bestehendes CT schraube, sondern da ist viel, viel mehr nötig …
Dr. rer. nat. Björn Kreisler
Die ersten Prototypen waren noch eine solche Kompromissvariante: der neuartige Detektor in einem alten System. Diese Prototypen waren deshalb auch nur sehr begrenzt einsetzbar, fernab vom klinischen Routinebetrieb. Damit war zunächst nur reiner Forschungsbetrieb möglich.
Dr. rer. biol. hum. Stefan Ulzheimer
Bezogen auf das Gesamtpaket – lassen Sie uns auch noch einmal über die Röntgenröhre sprechen. Hier gab es zwar immer auch inkrementelle Verbesserungen. Gerade wenn man in Richtung Hochauflösung denkt, die der Detektor in der Lage ist zu leisten, braucht man auf der anderen Seite auch eine Röntgenröhre, die das unterstützen kann. Die hatten wir über kontinuierliche Innovationen auch zur Verfügung, mit einem sehr kleinen Röhrenfokus. Denn es hilft nicht, wenn die Detektorelemente in einem CT kleiner werden, um höchstmögliche Auflösung zu erzeugen. Ich muss auch die Lichtquelle, den Punkt, von dem das Röntgenlicht ausgeht, so klein wie möglich machen. Und trotzdem möchte ich noch hohe Leistung, also hohe Röntgenlichtintensität, aus diesem kleinen Punkt bekommen. Auch das ist tatsächlich eine große Leistung, die wir schon zur Verfügung hatten, die auch für die konventionelle Technologie schon einen Mehrwert gebracht hat.
Prof. Dr. rer. nat. Thomas Flohr
Dieser lange und ineinandergreifende Innovationsprozess ist vielleicht auch eine schöne Botschaft für die immer mehr zur Kurzlebigkeit neigende Gesellschaft, die oft auch das Vorurteil pflegt, dass große Firmen nur von einem Quartalsbericht zum nächsten denken. Das hier ist ein Beispiel für ein Thema, das wir beharrlich über 20 Jahre verfolgt und erfolgreich realisiert haben – trotz dunkler Phasen während der Projektzeit, in denen wir wirklich kurz davor waren zu sagen, das wird nichts.
„Revolutionäre Einblicke in den menschlichen Körper“ soll dieses Gerät leisten. Welche Vorteile bietet es den Medizinern?
Prof. Dr. rer. nat. Thomas Flohr
Da fange ich mit dem langweiligsten an, der aber durchaus relevant ist – das ist die Reduktion der Strahlendosis. Jede herkömmliche CT-Untersuchung ist mit einer Strahlenbelastung für den Patienten verbunden und es gab viele Ansätze, diese zu reduzieren. Aber man ist da irgendwo limitiert. Mit dem neuen CT wird ein deutlicher Schritt bei der Reduktion der Strahlenbelastung geleistet. Warum? Das versuche ich mit der Analogie von vorhin zu erklären: Bei den Röntgenquanten gibt es kleine und große. Kleine Röntgenquanten sind die kleinen Wassertropfen, sie haben nur eine geringe Energie, die großen sind in der Analogie die großen Wassertropfen und die haben eine hohe Energie. Ein herkömmlicher Detektor summiert einfach nur auf, was diese Wassertropfen insgesamt angerichtet haben. Und da ist es klar, dass ein sehr großer Wassertropfen, also ein Wassertropfen mit einer hohen Energie, viel mehr zum Gesamtbild des Detektorsignals beiträgt als ein Wassertropfen mit einer kleinen Energie.
Wenn man auf ein Organ schaut, möchte man differenziert einzelne Kontraste in diesem Organ sehen, denn der Arzt muss auch den kleinen Tumor in der Leber erkennen, der sich nur ganz wenig von seiner Umgebung unterscheidet. Dann kommt es auf die kleinen Wassertropfen an, denn die machen gerade diesen feinen Unterschied in der Absorption aus. Gerade diese kleinen Wassertropfen, also Röntgenquanten, werden mit dem konventionellen Detektor viel zu gering berücksichtigt, weil sie im Vergleich zu den großen Wassertropfen einfach untergehen.
Der quantenzählende Detektor aber gewichtet sie alle gleich, er zählt auch die kleinen Wassertropfen mit genau dem gleichen Beitrag wie die großen. Das heißt, diese kleinen Wassertropfen, die jetzt auf einmal ein viel größeres Gewicht haben, stellen die kleinen Unterschiede im Objekt viel besser dar, als wenn man nur auf die großen Wassertropfen schaut. Das heißt, ich kann mit einer geringeren Menge von Wassertropfen ein viel besseres Bild malen. Die Menge an Wassertropfen ist aber meine Strahlendosis. Letztendlich kann ich aufgrund dieses Detektionsprinzips mit einer geringeren Strahlendosis für den Patienten ein besseres Bild des Organs erzeugen. Jede CT-Untersuchung wird mit einer geringeren Strahlendosis ablaufen können als bisherige Untersuchungen, und unsere klinischen Partner haben bereits eine Reduktion der Strahlendosis um bis zu 40 Prozent bestätigt.
Dr. rer. biol. hum. Stefan Ulzheimer
Es gehört zu den Vorteilen der Computertomographie, dass sie bei einem sehr großen Spektrum klinischer Applikationen eingesetzt wird: Pulmologie, Kardiologie, für fast alle Feststellungen von Krankheiten wird das CT als Diagnosewerkzeug eingesetzt. Jetzt kann man sich die besonderen Vorteile des neuen Detektors in diesen klinischen Feldern ansehen. Eines ist die Lungenheilkunde, Pulmologie, hier war die CT schon immer stark, trotzdem gab es Bereiche, für die man keine klaren Aussagen treffen konnte. Die neuen Detektoren, das sehen wir schon bei den ersten Studien, bieten große Vorteile, denn wir können die Auflösung um das Doppelte steigern. Das ist jetzt bei COVID-19 besonders wichtig, denn diese Erkrankung manifestiert sich hauptsächlich in der Lunge, wenngleich sie eher eine Gefäßerkrankung ist. Die Lungenbildgebung erfolgte bisher schon mit räumlichen Auflösungen im Submillimeter-Bereich. Das ist aber oft für eine klare Diagnose nicht ausreichend. Dadurch, dass wir nun in der Lage sind, die Auflösung zu steigern, können Bereiche in der Lunge, die auffällig, aber bisher nicht klar diagnostizierbar sind, deutlich besser abgebildet werden. Und das ist die Chance, eine viel bessere Differenzialdiagnose für solche Erkrankungen zu erhalten.
Das wäre ein sehr großer Mehrwert, auch was die Folgetherapie angeht. Welche Therapie schlägt an? Genau diese Bereiche sind mit der neuen Technik viel besser und genauer zu erfassen.
Dr. rer. nat. Björn Kreisler
Ein weiterer Vorteil noch: Jeder konventionelle Detektor hat ein Grundrauschen, das Elektronikrauschen – wenn die Strahlendosis niedrig ist, wird dieses Grundrauschen in den CT-Bildern deutlich störend sichtbar. Wie wenn man ein Foto mit sehr wenig Licht macht – das schaut dann auch krisselig aus. Unser neuer Detektor hat dieses Grundrauschen nicht. Man ist vom elektronischen Rauschen nicht mehr begrenzt und kann bei der Strahlendosis, wie es Thomas Flohr schon dargestellt hat, deutlich weiter runtergehen, als es bisher möglich ist. Jetzt kann man auch über Screening-Anwendungen nachdenken, weil man selbst einzelne Röntgenquanten, die am Detektor ankommen, sauber detektiert. Die Röntgenquanten gehen nicht mehr in einem Rauschen unter, wie das bei Fotodioden-basierten Systemen der Fall ist.
Prof. Dr. rer. nat. Thomas Flohr
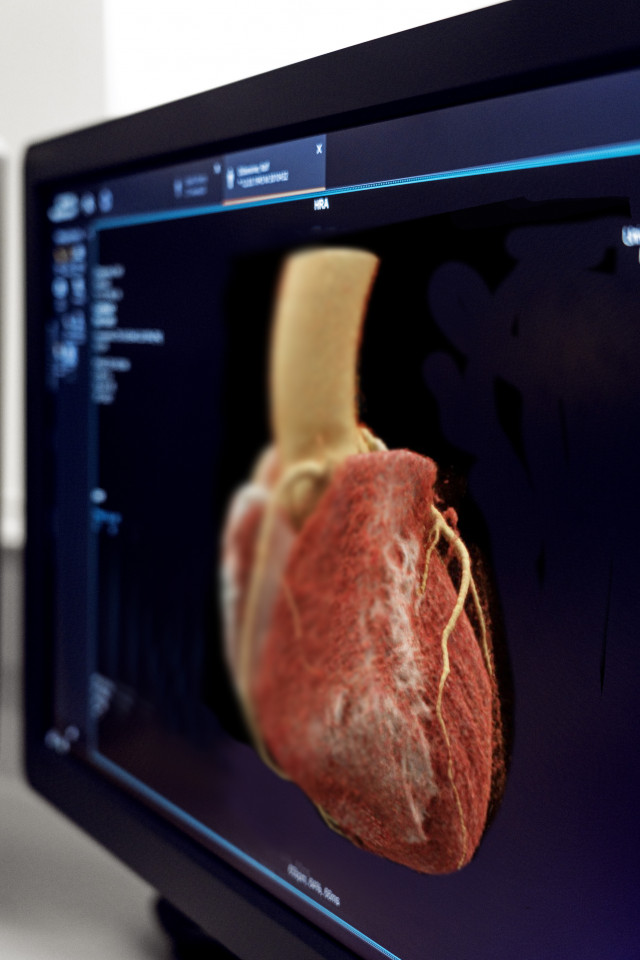
Ein wichtiges klinisches Beispiel, das auch erklärt, warum man das Gesamtpaket – zwei Strahler, zwei quantenzählende Detektoren – braucht, ist eine Herz-CT-Untersuchung. Viele Patienten – etwa vier Millionen jährlich in Deutschland – haben Probleme mit den Herzkranzgefäßen. Früher wurden diese Probleme im Wesentlichen mit Herzkatheteruntersuchungen geklärt, heute kann man das gut mit einem Herz-CT untersuchen. Damit kann man die Herzkranzgefäße, die für diese Untersuchung mit jodhaltigen Kontrastmitteln gefüllt werden, gut und sehr scharf abbilden und unmittelbar sehen, ob sich relevante Verengungen oder Ablagerungen (Plaques) in den Koronararterien befinden. Auf dieser Basis lässt sich entscheiden, ob im nächsten Schritt eine Herzkatheteruntersuchung notwendig ist oder nicht. Viele Betroffene haben nicht nur die Verengungen der Herzkranzgefäße, sondern auch gleichzeitig Kalk. Dieser Kalk muss für die Blutversorgung des Herzmuskels nichts bedeuten, er ist in den Herzkranzgefäßen da, aber er verengt sie nicht. Die Durchblutung der Herzkranzgefäße ist gegeben, so dass ein solcher Patient nicht zwingend einen Herzkatheter braucht. Bei manchen Patienten ist jedoch der Kalk in den Koronararterien so dominant, dass man mit der herkömmlichen CT-Untersuchung nicht mehr sehen kann, ob das Gefäß dahinter frei ist, denn das herkömmliche CT reagiert nur auf Absorptionsunterschiede, der Kalk und das kontrastgefüllte Gefäß werden praktisch gleichartig abgebildet.
Mit unserem „Farbfernseher“ kann man dagegen genau unterscheiden, was ist das mit Kontrastmittel gefüllte Lumen und was ist Kalk. Man kann den Kalk auch durch geschickte Datenverarbeitungsschritte unter Ausnutzung der Farbinformation aus den Bildern entfernen, um den Blick auf das eigentliche Gefäßlumen zu ermöglichen. Aber trotzdem benötigt man ein scharfes Bild, um das Herz vernünftig abbilden zu können. Farbfernsehen alleine reicht nicht, wenn dieser Farbfernseher eine Belichtungszeit von einer Sekunde pro Bild hat. Hier kommt das Dual-Source-Prinzip wieder ins Spiel, deswegen haben wir zwei Messsysteme eingebaut. Damit ist gleichzeitig die Belichtungszeit für das Bild so kurz, dass sich das Herz unbewegt, scharf, mit hoher räumlicher Auflösung und in Farbe abbilden lässt. Und in Farbe ergibt sich die Unterscheidung: Das ist Kalk, das ist Jod und man kann sagen, das ist das tatsächliche Gefäßlumen und dieser Kalk ist relevant oder nicht.
Dr. rer. nat. Björn Kreisler
Der direkte Patientennutzen ist, dass dies ein nichtinvasives Verfahren ist, eine Herz-CT-AAufnahme dauert wenige Sekunden, oft weniger als eine Sekunde. Die eigentliche Aufnahme ist für den Patienten kein Problem, es dauert fünf Minuten im CT mitsamt Lagerung, bis er den Raum wieder verlassen kann. Im Vergleich zu einer invasiven Untersuchung, wenn der Katheter in die Herzkranzgefäße geschobert wird, ist das wesentlich weniger Belastung und natürlich sind es auch wesentlich geringere Kosten. So ein Herz-CT kostet vielleicht – je nach Land, wenn die Krankenkassen dafür bezahlen – 200 bis 400 Euro und eine diagnostische Katheteruntersuchung kostet um die 1.000 Euro.
Durch Ihre Umsetzung ergeben sich auch Vorteile für Patienten bei der Gabe von Kontrastmittel?
Prof. Dr. rer. nat. Thomas Flohr
Im CT bekommt der Patient ein jodhaltiges Kontrastmittel. Warum? Eine Computertomographie ist eine Methode, die nur auf Röntgenschwächung der unterschiedlichen Organe reagiert. Nun haben alle Weichgewebe – Leber, Herz, Gallenblase, die Milz – fast die gleiche Schwächung. Wenn man ein CT-Bild ohne Kontrastmittel anschaut, ist das grau in grau, wie durch einen Schleier. Deswegen gibt man ein Kontrastmittel. Jod hat eine sehr hohe Röntgenschwächung und wo das Jod hinfließt, hat man auch im CT-Bild eine deutlich höhere Schwächung, als man das vorher gehabt hätte. Hohe Röntgenschwächung heißt immer, dass es im Bild hell wird. Wo das Kontrastmittel ist, sieht man eine Aufhellung und die Gefäße werden deutlich von ihrer Umgebung abgesetzt.
Man sieht auch Organe wie die Leber. Das Leberparenchym nimmt das Kontrastmittel auf und ist dann deutlich aufgehellt. Das ist wichtig für die Differentialdiagnose, weil sich nur so z. B. bestimmte kleine Veränderungen darstellen lassen. Ein bestimmter Lebertumor kann etwas weniger oder etwas mehr Kontrastmittel aufnehmen als gesundes Lebergewebe und plötzlich ist das deutlich sichtbar. Kontrastmittel in den Gefäßen sorgt dafür, dass sich die Gefäße deutlich von ihrer Umgebung absetzen und nur so kann ich überhaupt die Herzkranzgefäße sehen.
Jod ist ein gängiges Kontrastmittel, ein sehr sicheres, erprobtes Kontrastmittel, es hat aber ein paar Eigenschaften, die, unabhängig von den medizinischen Eigenschaften, nicht so gut sind. So zum Beispiel, dass die Absorption von Jod bei ganz schwergewichtigen Patienten immer noch viel zu gering, der Jodkontrast immer noch nicht ausreichend ist. Dann will man bei bestimmten Anwendungen das Jod sehen, zusätzlich noch weitere Veränderungen in dem Organ. Ein Beispiel: Es gibt Leberkrebsbehandlungen, dabei wird der Tumor durch eine sogenannte Chemoembolisation behandelt. Man bringt ein Chemotherapeutikum direkt in die Leber, aber damit man sehen kann, wo es sich ausgebreitet hat, wird es mit einem Kontrastmittel gekoppelt, dem jodbasierten Lipiodol. Damit kann man sehen, wo das Kontrastmittel und damit auch das Therapeutikum eingedrungen ist. Bei Folgeuntersuchungen will man sehen, ob der Tumor abgestorben ist, aber das Lipiodol ist in der Leber und überschattet dann bei Folgeaufnahmen das Leberbild. Also wäre es dann sinnvoll, ein anderes Kontrastmittel zu haben, das anders ist als Jod. Zumal man mit dem neuen Detektor, diesem „Farbfernseher“, nicht nur zwei, sondern auch drei oder vier Farben zeigen kann und somit weitere Kontrastmittel sichtbar machen könnte.
In dieser Fragestellung arbeiten wir mit der pharmazeutischen Industrie, konkret mit der Bayer AG, auch an der Entwicklung solcher neuen Kontrastmittel intensiv zusammen, die dann insbesondere im Zusammenhang mit dem photonenzählenden Detektor neue klinische Anwendungen erschließen.
Dr. rer. biol. hum. Stefan Ulzheimer
CT gibt es jetzt etwa seit 50 Jahren als medizinische Bildgebung und Jod gibt es als Kontrastmittel auch schon sehr lange. Aber nachdem es bisher kein CT gab, das verschiedene Kontrastmittel unterscheiden konnte, gab es für die Hersteller keinen Anreiz, neue Kontrastmittel zu entwickeln. Wir sehen jetzt sehr viel Interesse und Forschungsaktivität in Richtung neuer Kontrastmittel. Es gab Grundlagenforschung in dem Bereich, aber bisher keine Ansätze, das zu einem Produkt zu machen. Das ändert sich gerade.
Dr. rer. nat. Björn Kreisler
Bei einigen Anwendungen möchte man auch Kontraste in den verschiedenen Phasen der Kontrastmittelaufnahme sehen. Man spritzt heute dem Patienten ein Kontrastmittel, macht ein Bild und wiederholt das nach wenigen Minuten. Mit zwei unterschiedlichen Kontrastmitteln könnte man Kontrastmittel Nummer eins spritzen, nach wenigen Minuten das zweite und müsste dann nur noch ein Bild machen, das dennoch beide Informationen enthält.
In der langen Entwicklungszeit der Innovation gab es Phasen, die Sie am Erfolg haben zweifeln lassen. Was hilft in solchen Situationen?
Dr. rer. biol. hum. Stefan Ulzheimer
Wenn man denkt, dass es nicht weitergeht, hilft es, sich einen externen Blick auf die Dinge zu holen. Wenn man vielleicht auch zu viele Informationen hat und nicht mehr weiß, wie die einzelnen Dinge zu bewerten sind. Ja, das haben wir in mehreren Stadien gemacht. Das war interne Hilfe von unserer Mutterfirma, Corporate Research, einer zentralen Forschungs- und Entwicklungsabteilung, die Hilfestellung gibt, mit Experten, die Technologien bewerten, basierend darauf, ob sie dafür eine Chance sehen, dass daraus ein Produkt wird.
Das ist ein sehr systematischer, strukturierter Prozess, bei dem die Kollegen alle Felder abgeklopft haben. Das wird gemeinsam erarbeitet und dabei fallen plötzlich Dinge auf, bei denen man nochmal genauer reinschauen, nacharbeiten will. Wir haben das zweimal gemacht, beim ersten Mal, so 2012, war man sich noch sehr unsicher. Dann haben wir daran gearbeitet, es wurde nochmal angeschaut und damit war auch die Entscheidung gefallen, dass wir uns sicher waren, mit dieser Technologie ein Produkt bauen zu können: Manchmal hilft einem ein Blick von jemandem, der nicht direkt im Projekt involviert ist, selbst Dinge neu zu strukturieren und zu bewerten.
Dr. rer. nat. Björn Kreisler
Der es auch selber gar nicht technisch verstehen muss. Der muss nur die richtigen Fragen stellen. Das hat uns deutlich weitergebracht.
Prof. Dr. rer. nat. Thomas Flohr
Beim Detektor war es eine Aneinanderreihung mehrerer Schritte, die das Material besser und besser und besser gemacht haben.
Dr. rer. nat. Björn Kreisler
Beim Detektormaterial gab es über Jahre eine sehr graduelle Entwicklung, jetzt geht es in großen Schritten weiter.
Dr. rer. biol. hum. Stefan Ulzheimer
Wichtig ist: Nachdem wir ja ein eher kommerzielles Produkt entwickelt haben, spielt nicht nur die technische Machbarkeit eine Rolle, sondern auch die Kosten. Damit haben wir uns sehr früh beschäftigt. Denn egal, wie großartig das ist oder was es für einen großen Nutzen bringt, die Budgets am Markt sind natürlich limitiert. Das heißt, die Innovation muss zum Markt passen und zu den zur Verfügung stehenden finanziellen Möglichkeiten im Gesundheitssystem. Von daher war es eine parallele Aufgabe, diesen Detektor auch bezahlbar zu machen.
Dr. rer. nat. Björn Kreisler
Die ersten Ansätze waren exorbitant teurer als ein konventionelles CT. Inzwischen sind wir mit den Detektorkosten pro Fläche sehr nahe an die konventionelle Technologie herangekommen und daran wird kontinuierlich weitergearbeitet.
Im Moment wird das neue CT dann vorwiegend bei Kliniken zu finden sein. Ist absehbar, dass auch der Radiologe in der Praxis sich dieses Gerät leisten kann?
Dr. rer. biol. hum. Stefan Ulzheimer
Das ist unser klares Ziel. Wir wollten von vornherein kein hochpreisiges Nischenprodukt entwickeln. Prinzipiell kann die Technologie in das gesamte Produktspektrum Einzug halten und Schritt für Schritt konventionelle Detektoren ersetzen. Das Preisspektrum ist sehr groß, es ist von der Konfiguration und vom jeweiligen Markt abhängig. Man kann heute ein CT für 200.000 Euro bis 3 Millionen Euro kaufen. Im Moment geht es uns wie vielen anderen Industrien: Neue Technologien werden erst mal am oberen Ende der Preisspanne eingeführt, im Highend-Segment, aber unser Ziel ist ganz klar, sie dann auch in niedrigpreisige Segmente einzubringen. Wir haben diese Technologie nicht über 20 Jahre entwickelt, um sie dann in einer Highend-Nische stehen zu lassen!
Wie sieht der Markt für das Produkt aus?
Dr. rer. biol. hum. Stefan Ulzheimer
Wir sind überzeugt, dass die neue Technologie mittel- bis langfristig in jedem Computertomographen unseres Unternehmens eingesetzt wird. Unabhängige Markt-Prognosen rechnen mit bis zu 130.000 CT-Systemen weltweit, die durch quantenzählende CTs abgelöst werden könnten. Diese Entwicklung wird im weiteren Verlauf auch die Kontrastmittelforschung weiter intensivieren und zur Ausprägung neuer Forschungsschwerpunkte im Bereich der Verfahrenstechnik sowie der intelligenten Verarbeitung großer Datenmengen beitragen.
Bedarf es jetzt für das medizinische Fachpersonal einer besonderen Schulung im Umgang mit diesen neuen Geräten?
Prof. Dr. rer. nat. Thomas Flohr
Wir haben darauf geachtet, das Gerät so zu bauen, dass die technischen Komplexitäten zumindest bei Routineanwendungen für den Benutzer so versteckt und so gekapselt sind, dass man das Gerät einfach bedienen kann. Als Anwender*in dieses Gerätes möchte man nicht zwischen verschiedenen Energiespektren und verschiedenen Betriebsarten des Detektors wählen, sondern einfach in gewohnter Weise eine CT-Untersuchung machen. Das Gerät soll automatisch dafür sorgen, dass die richtigen Parameter für die Untersuchung und den entsprechenden Patienten vorgeschlagen werden. Das war neben dem rein technischen Entwicklungsschritt ein weiterer wesentlicher Punkt, das Gerät vom Arbeitsablauf her so zu gestalten, dass es einfach zu nutzen ist. Das ist vielleicht ein Detail, aber für die radiologische Praxis sehr wichtig. Wir haben großes Augenmerk darauf gelegt, dass die Ergebnisse, die dieses Gerät liefert – das ist auch durch den neuen Detektor bedingt –, standardisierter und quantitativer sind als die Ergebnisse bisheriger CT-Geräte. Bei diesen hing viel von der Art ab, wie das CT-Gerät bei der Aufnahme betrieben worden ist, welche technischen Parameter eingestellt wurden. Da werden durchaus unterschiedliche Bildeindrücke erzielt, weil der eine Anwender das so bedient hat, der andere anders. Das versuchen wir mit dem neuen Gerät zu standardisieren. Das ist wichtig bei allen Patienten, die Folgeuntersuchungen haben. Eines der Hauptanwendungsgebiete der CT ist die Krebsdiagnose und vor allem das Therapiemonitoring. Hier ist es schon sehr, sehr hilfreich, wenn die Bilder standardisiert und unmittelbar vergleichbar sind.
Die einzelnen Schritte der Innovation sind durch eine lange Liste an Patenten abgesichert. Wie sieht es mit dem Wettbewerb aus?
Dr. rer. nat. Björn Kreisler
Die anderen großen Hersteller kommen – mit deutlichem Abstand – hinterher, wollen auch in den Markt. Es gibt Prototypen, zum Teil auch sehr alte Veröffentlichungen, wo mal gezeigt worden ist, dass es prinzipiell geht. Wir beobachten das, aber da ist im Moment nichts sichtbar, das unsere Markteinführung gefährden würde.
Dr. rer. biol. hum. Stefan Ulzheimer
Hier sollte man einmal auf den Umgang mit Patenten in der Medizintechnik verweisen. Wenn die breite Öffentlichkeit hört, dass etwas mit Patenten abgesichert ist, wird das verstanden, das sichert das Produkt ab, wie bei einem Medikament. In der Medizintechnik ist die Entwicklung so komplex und beinhaltet so viele technische Komponenten, die wiederum so viele Teilaspekte haben, die man unter Umständen als „Intellectual Property“ absichern kann. Das spielt bei uns aber keine große Rolle.
Wir haben auch sehr früh entschieden, dass wir uns nicht auf Patentstreitigkeiten mit unseren Wettbewerbern einlassen wollen, sondern wir wollen uns darauf konzentrieren, möglichst schnell und ohne uns gegenseitig zu behindern sinnvolle Produkte auf den Markt zu bringen. Und wer schneller ist, der hat einfach den Vorteil: „time to market“. Wir verklagen uns nicht gegenseitig, im Gegenteil. Jeder bekommt Zugriff auf das Patentportfolio des anderen. So funktioniert es unter den großen CT-Herstellern auf der Welt.
Von daher sind solche Dinge eigentlich von untergeordneter Bedeutung in unserem Bereich. Das ist eigentlich eine ganz charmante Geschichte, weil viele denken, Kommerzialisierung funktioniert nur so: Man erfindet etwas, sichert es als Patent ab und dann nutzt man das Ganze, solange das Patent noch läuft. Das funktioniert bei uns grundsätzlich anders.
Das Grundprinzip ist: Wir streiten uns nicht über Patente. Wir schauen, dass wir möglichst schnell gute Produkte entwickeln und Innovationen in den Markt bringen.
Prof. Dr. rer. nat. Thomas Flohr
Wir patentieren, wir patentieren auch sehr viel, aber nicht mit dem Ziel, anderen das zu verweigern. Wenn andere Hersteller mit einem quantenzählenden CT später dran sind als wir, liegt es nicht daran, dass wir sie durch Patente daran hindern, sondern das hat andere Gründe.
Was bringt Ihre Innovation für die Gesellschaft?
Prof. Dr. rer. nat. Thomas Flohr
Unsere Innovation erbringt für die Gesellschaft die frühere Diagnose von Krankheiten, die bessere Diagnose von Krankheiten – und vielleicht auch die Möglichkeit, Krankheiten nicht nur in irgendeiner Form zu diagnostizieren, sondern auch Therapieentscheidungen abzuleiten, und als Patient über die sinnvolle Therapie in Eigenverantwortung mitzuentscheiden.
Dr. rer. nat. Björn Kreisler
Und das Ganze bei einer niedrigeren Strahlendosis als bisher.
Dr. rer. biol. hum. Stefan Ulzheimer
Der gesellschaftliche Nutzen ist, gerade wenn man am Anfang der Produktimplementierung am Markt steht, noch schwer messbar. Aber lassen Sie uns zurückschauen, was die Computertomographie als gesellschaftlichen Nutzen gebracht hat: Mitte der 70er Jahre war ein Standardvorgehen bei bestimmten Beschwerden, den Patienten aufzuschneiden, um herauszufinden, was ihm fehlt – explorative Chirurgie. Solche Verfahren sind heute praktisch auf Null heruntergefahren. Für einen Patienten ist es ein großer Unterschied, ob man ihn aufschneiden muss oder durch ein CT oder MRT schiebt. Thomas Flohr hat es kurz zusammengefasst. Die Innovation leistet nicht nur die eindeutigere Diagnose, sondern auch ein erhebliches Potential in Richtung bessere, frühere Therapie für den Patienten.
Jetzt möchten wir noch ein wenig Persönliches von Ihnen wissen.
Herr Prof. Flohr, was hat Sie seinerzeit gereizt, Physik zu studieren und dann in die Medizintechnik einzusteigen?
Prof. Dr. rer. nat. Thomas Flohr
An der Physik als solche hat mich ursprünglich mal gereizt, dass ich verstehen wollte, was die Welt so im Inneren zusammenhält: Ich schaue aus dem Fenster, der Himmel ist blau, der könnte doch auch grün oder rot sein. Und wenn ich jemanden
: Hast du dir mal überlegt, warum der Himmel nicht grün ist, dann schauen sie mich verständnislos an. So etwas war einer der Gründe, Physik zu studieren. Nach dem Studium habe ich aber auch gemerkt, nur zu wissen, was die Welt im Inneren zusammenhält, reicht nicht, irgendwie musst du auch von dem, was du machst, leben. Das entwickelte sich doch in Richtung Industrie und ich habe mich eigentlich relativ schnell für die Medizintechnik bei Siemens entschieden und bin während meiner gesamten Laufbahn hier geblieben. Einfach weil ich hier erleben konnte, wie man das, was ich gelernt habe, so ein gewisses physikalisches Wissen, in etwas Nützliches verwandeln kann. Nicht mit dem hochtrabenden Anspruch: in etwas Nützliches für die Gesellschaft, sondern einfach in etwas Nützliches. In etwas, bei dem man sehen kann, wie das realisiert und tatsächlich angewendet wird. Etwas, das tatsächlich irgendwo steht und verwendet wird. Das ist ein ganz anderer Aspekt, als zu sagen, ich habe da jetzt für eine Schublade geforscht und vielleicht wird die Nachwelt in 100 Jahren mal erkennen, wie genial das war. Das ist hier viel mehr „down to earth“, aber es wird unmittelbar umgesetzt und unmittelbar angewendet. Das hat mich eigentlich die ganzen Jahre über hier gehalten.
Wie war das denn bei Ihnen, Sie sind ja auch in die Physik eingestiegen?
Dr. rer. nat. Björn Kreisler
Die Frage nach dem Warum ist, glaube ich, das Entscheidende. Warum das eine oder andere so oder so funktioniert, wo sind Grenzen oder wo gibt es noch Möglichkeiten, weil man es noch nicht bis zum Ende durchdacht hat. Und das passiert eben nicht auf der Basis von: Ich wende eine Formel an und bekomme ein Ergebnis. Die
ist, warum ist die Formel so? Das ist der Teil, der mich schon immer gereizt hat. Und ich hatte das Glück, in Erlangen, im Studium gab es einen Schwerpunkt Medizin. Ein Medizinphysik-Aspekt in der Kern- und Teilchenphysik, den ich aktiv gewählt habe. So bin ich zu den Photonenzählern gekommen. Das in der Medizinphysik anzuwenden, war dann der konsequente Schritt. Und das macht mir bis heute eine Menge Freude, hier zusammen mit vielen Kolleg*innen immer noch Medizinphysik machen zu können.
Dr. rer. biol. hum. Stefan Ulzheimer
Wenn ich zurückdenke, war es die Neugier, die Faszination, dass man viele Effekte in der Natur auf wenige Grundlagen zurückführen kann, mit denen man wiederum viele Dinge erklären kann. Ich habe dann tatsächlich begonnen Physik zu studieren, weil mich das interessiert hat, aber auch, weil ich das irgendwie als Herausforderung gesehen habe. Und nach dem Grundstudium musste man sich entscheiden, ob man mehr in Richtung angewandte oder eher theoretische Physik geht. Das war für mich nie eine
– ich wollte immer anwendungsorientierte Dinge tun. Ich habe im Hauptstudium optische Messtechnik studiert, das hatte noch nichts mit Medizintechnik zu tun, obwohl wir damals einen Zahnsensor gebaut haben, der inzwischen, glaube ich, Standard ist. Das ist jetzt auch schon 25 Jahre her, dass man den Zahn vermisst, die Daten ins Labor schickt und dann das Inlay oder die Krone zurückbekommt.
Dann gab es auch viele Zufälle, etwa, dass hier das Institut für Medizinische Physik neu gegründet wurde. Ich habe im Hauptstudium schon Physikpraktika für Mediziner gemacht. Damit kam dann irgendwie der Kontakt zustande, dass ich dann letztendlich in Medizintechnik promoviert habe.
Herr Prof. Flohr, Sie haben sich habilitiert und lehren auch an der Uni Tübingen Medizinische Physik. Was bringt Ihnen persönlich dieses Wechselspiel zwischen – das kann man sagen – einer unternehmerischen Verantwortung für ein solches Projekt und der Lehre?
Prof. Dr. rer. nat. Thomas Flohr
Es war immer faszinierend, solche Themen auch an Studenten zu vermitteln. Ich finde das wirklich spannend, mit jungen Leuten zu diskutieren, die Medizintechnik oder Biomedizinische Technologien, so heißen die Fächer in Tübingen, studieren, ihnen die Grundlagen der Computertomographie nahezubringen und auch zu sehen, wie sie darauf reagieren und auch zu überlegen, wie ich das selber besser darstellen kann. Das ist mir unheimlich wichtig. Aus dieser Tätigkeit sind auch Kontakte zu Studenten entstanden, die ein Praktikum machen wollten und dann später sogar zu ihrer Masterarbeit zu uns gekommen sind. Etwas Nachwuchswerbung soll aus dem, was wir machen, ja auch entstehen.
Das, was wir tun, soll bekannt werden. Ich wollte nie im Elfenbeinturm festsitzen und dennoch weiterhin wissenschaftlich aktiv bleiben. Oft ist man ja als Industriephysiker abgestempelt: „Der ist doch verloren für die Wissenschaft!“ Zu zeigen, dass dies nicht so ist, das hat mich angetrieben. Wir haben bei uns auch Doktoranden oder Masterstudierende und ich finde es wichtig, dem Nachwuchs zu zeigen, dass es als Physiker auch ein Leben in der Industrie gibt und damit junge Menschen für diesen Weg zu begeistern.
Was auch wesentlich für die Entwicklung des quantenzählenden Detektors war, ist der gute Kontakt zu den radiologischen Kliniken. Wir haben sechs Prototypen dieser Geräte früh bei klinischen Partnern installiert. Und deren Feedback rechtzeitig aufzunehmen, zu bewerten, einzuarbeiten, das ist sehr, sehr wertvoll. Dieser Aspekt ist auch durch die Unilaufbahn in Tübingen entstanden, auch durch meine Habilitation.
Die besondere Liebe für den Detektor … Was macht das spannend? Was würden Sie einem jungen Menschen sagen, der sich für dieses besondere Gebiet interessiert?
Dr. rer. nat. Björn Kreisler
Das, was wir tun, ist unglaublich vielseitig. Wir haben bei uns sehr viele Materialwissenschaftler, die wirklich von Grundelementen, die im Periodensystem stehen, bis zum vollen Detektor das Material durchtragen. Es gibt viel sehr hardwarenahe Programmiertätigkeit, es gibt viele sehr grundlegende
n der Aufbau- und Verbindungstechnik, Schaltungs- und Hardwaredesign … Es sind sehr viele Gebiete, Fachbereiche, die man zusammenfügen muss, die nur gemeinsam funktionieren. Die Kommunikation in so einem vielseitigen Team ist sehr wichtig und es kann jeden Tag etwas Neues kommen, jeden Tag ein Problem auftauchen, bei dem jemand sagt, das kann nicht gehen. Und dann findet man einen Weg, wie man weitermacht und vorankommt – und dann geht es doch. Diese Flexibilität, die man da braucht, macht es unglaublich spannend.
Die Digitalisierung ist derzeit ein beherrschendes Thema in der Medizin, auch in der Medizintechnik. Machen wir einen Zeitsprung. Wie sieht denn die Entwicklung in Ihrem jeweiligen Arbeitsbereich in fünf Jahren aus? Haben Sie eine Vision?
Prof. Dr. rer. nat. Thomas Flohr
In fünf bis zehn Jahren hat sich die „quantenzählende CT“ verbreitet, ist nicht nur im High-end, sondern auch in anderen Segmenten zu Hause, auch der niedergelassene Radiologe kann sich ein solches Gerät kaufen. Dieses Gerät ist jetzt aber nicht nur blanker Sensor, also eine Art Fotoapparat, der schöne bunte Bilder macht, sondern die Digitalisierung ist vorangeschritten und dieses Gerät ist wirklich vernetzt. Es liefert zum Teil Entscheidungsvorlagen für den Arzt, kann zum Teil die Bilder analysieren, den Arzt auf Veränderungen hinweisen. Und dieses Gerät ist vom Handling und vom Workflow her noch viel einfacher und automatisierter geworden als das heutige.
Dr. rer. nat. Björn Kreisler
Was den Detektor angeht, sind wir noch nicht am Ende der Entwicklung, so viel steht fest.
Gibt es dann zukünftig andere Materialien, so wie es irgendwann in der Entwicklung das Cadmium-Tellurit war?
Dr. rer. nat. Björn Kreisler
Bei Cadmium-Tellurit hieß es, das ist das Material der Zukunft und wird es immer bleiben – so als würde es nie kommen. Den Schritt haben wir gemacht, wir haben es jetzt als Detektormaterial so weit, dass es ein Produkt wird. Ich glaube trotzdem, da wir weiter Detektoren auf einer sehr manufakturähnlichen Basis fertigen, wird es weiterhin Abstimmungs- und Justierbedarf geben. Wir werden viel lernen, auch welche Materialien wir zusammenbringen können, was wir vielleicht besser trennen oder anders aufbauen müssen. Ein Detektor besteht aus vielen Subkomponenten, die man vielleicht geschickter zusammenfassen kann, wenn man noch mehr gelernt hat.
Und Ihre Vision?
Dr. rer. biol. hum. Stefan Ulzheimer
Wir haben schon kurz darüber gesprochen, wo wir hinwollen. Wir wollen, dass diese neue Technologie Einzug in alle unsere Produkte hält, in jedem Segment die Vorteile zum Tragen kommen. In fünf Jahren wäre die Vision, dass wir, wenn man das ganz grob segmentiert, Einstiegsmodelle, Mittelklasse, Oberklasse haben und dass wir mit den Innovationsvorteilen von der Oberklasse in die Mittelklasse der CT-Geräte vorgedrungen sind. Was den klinischen Nutzen angeht, haben wir auch einen ganz klaren Fokus: diesen dann tatsächlich quantifizierbar zu machen, auch den gesellschaftlichen Nutzen quantifizierbar zu machen. Ein Beispiel kann ich nennen, nachdem es auch viel um kardiovaskuläre Bildgebung geht: In fünf bis zehn Jahren gibt es keinen diagnostischen Katheter mehr, keine diagnostische Katheteruntersuchung für die Koronararterien zum Ausschluss von signifikanter Stenose. Wenn man das mal plakativ für die Kardiologie und entsprechend in vielen anderen klinischen Bereichen darstellt, haben wir den eindeutigen Plan, die Vorteile dieser neuen Technologie herauszuarbeiten und quantifizierbar zu machen.
Letzte Frage
Was gibt es außerhalb der Photonen, was bewegt Sie außerhalb dieser Mauern hier?
Dr. rer. biol. hum. Stefan Ulzheimer
Im Moment sind das ehrlich gesagt hauptsächlich meine drei Kinder, die noch recht jung sind, sieben, vier und ein Jahr alt. Sobald ich fünf Minuten zu Hause bin, habe ich vergessen, was hier passiert. Die bringen einen sehr schnell wieder auf den Boden der Tatsachen.
Prof. Dr. rer. nat. Thomas Flohr
Meine Kinder sind schon älter, sie beschäftigen mich jetzt nicht mehr so sehr. Ich mag Musik gern, spiele auch sehr gern Klavier. Und ich koche gerne …
Dr. rer. nat. Björn Kreisler
Wir haben auch zwei Kinder in einem ähnlichen Alter wie Stefans Nachwuchs, sieben und zehn. Die halten einen auf Trab … Ansonsten gibt es einen Garten, der von mir sehr gerne genutzt und bearbeitet wird. Und der Sport mit Freunden darf auch nicht zu kurz kommen.
Vielen Dank für das Gespräch.


 Gebärdensprache
Gebärdensprache
 Leichte Sprache
Leichte Sprache